Contextus et Designatio Studii
Retatrutidum (LY3437943) est novum medicamentum peptidicum singulare quod activat...tres receptores simulGIP, GLP-1, et glucagonum. Ad efficaciam et salutem eius in individuis obesitate laborantibus sed diabete carentibus aestimandam, experimentum clinicum phasis 2, aleatorium, dupliciter caecum, placebo-comparatum peractum est (NCT04881760). Summa...Participantes 338Pacientes cum indice massae corporis (IMC) ≥30, vel ≥27 cum saltem una comorbiditate ponderis conexa, randomizationi divisi sunt ut placebo vel retatrutidum (1 mg, 4 mg cum duobus schematibus titrationis, 8 mg cum duobus schematibus titrationis, vel 12 mg) semel in hebdomada per injectionem subcutaneam per 48 hebdomadas acciperent.finis primariusfuit mutatio percentualis ponderis corporis ad hebdomades 24, cum finibus secundariis inclusis mutatione ponderis ad hebdomades 48 et liminibus categoricis amissionis ponderis (≥5%, ≥10%, ≥15%).
Resultata Clavia
-
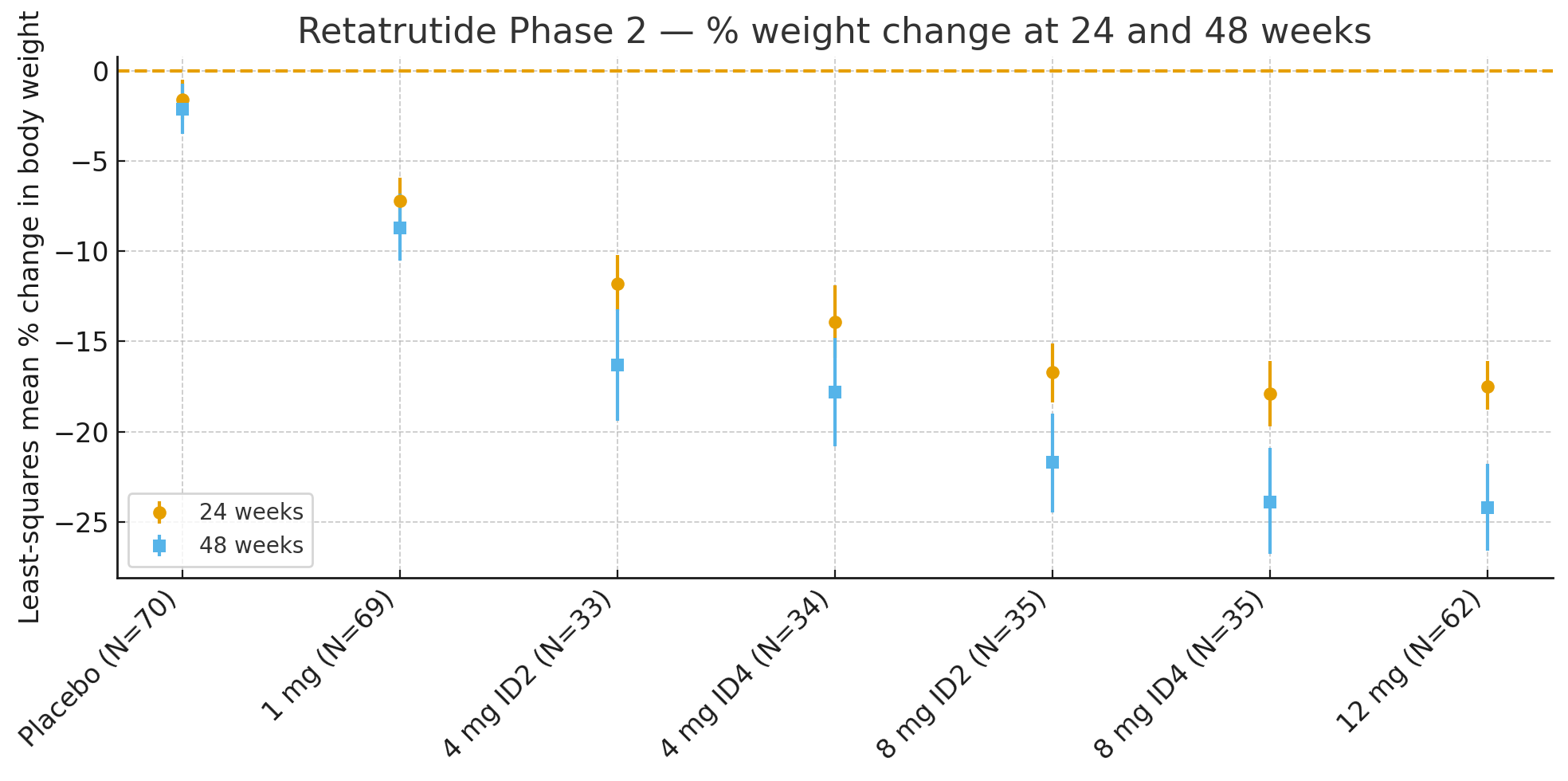
Viginti quattuor hebdomadesMutatio ponderis corporis secundum mensuram minimorum quadratorum, respectu lineae basalis, erat
-
Placebo: −1.6%
-
1 mg: −7.2%
-
4 mg (combinata): −12.9%
-
8 mg (combinata): −17.3%
-
12 mg: −17.5%
-
-
Quadraginta octo hebdomadesMutatio percentualis ponderis corporis erat
-
Placebo: −2.1%
-
1 mg: −8.7%
-
4 mg (combinata): −17.1%
-
8 mg (combinata): −22.8%
-
12 mg: −24.2%
-
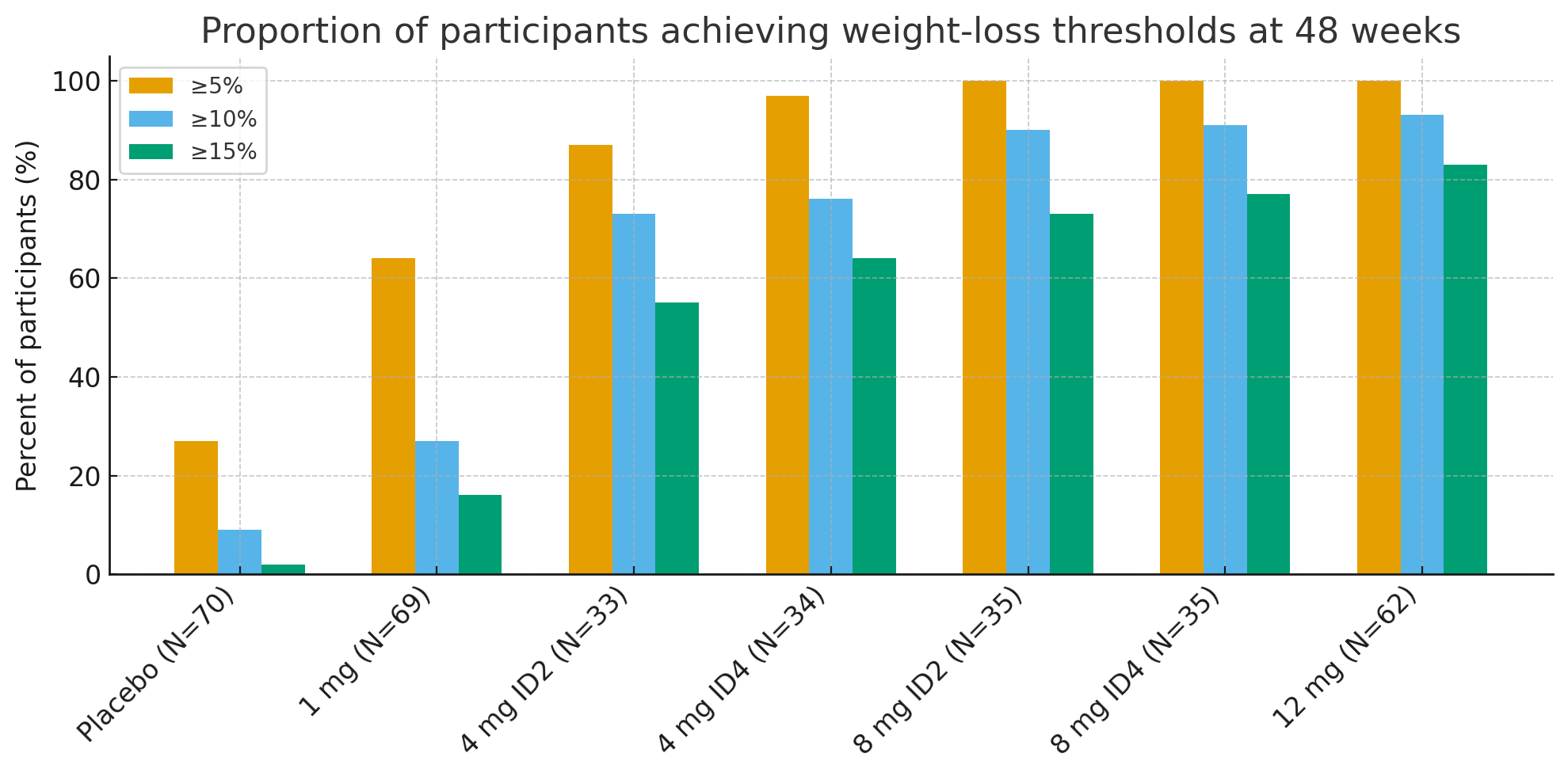
Hebdomadibus quadragesimo octavo, proportiones participantium qui limites ponderis amittendi clinicē significans attingebant insigniter notabiles erant:
-
≥5% amissio ponderis: 27% cum placebo contra 92–100% in cohortibus activis
-
≥10%: 9% cum placebo contra 73–93% in cohortibus activis
-
≥15%: 2% cum placebo contra 55–83% in cohortibus activis
In grege 12 mg, usque ad26% participantium ≥30% ponderis initialis amiserunt., magnitudo ponderis amissi comparabilis chirurgiae bariatricae.
Salus
Frequentissimi eventus adversi gastrointestinales (nausea, vomitus, diarrhoea) fuerunt, plerumque leves vel moderati et dosi relati. Doses initiales inferiores (titratio 2 mg) hos eventus minuerunt. Incrementa cordis frequentiae dosi relata observata sunt, ad summum pervenientes hebdomadam 24, deinde decrescentes. Rationes discontinuationis inter 6 et 16% per greges activos variabant, paulo altiores quam placebo.
Conclusiones
In adultis obesitate sine diabete, retatrutidum subcutaneum hebdomadaliter per 48 hebdomades produxit.substantiales, dosi dependentes reductiones ponderis corporis(usque ad ~24% iacturam mediam in dosi maxima), una cum meliorationibus in indicibus cardiometabolicis. Eventus adversi gastrointestinales frequentes sed titratione tractabiles erant. Haec inventa periodi 2 suggerunt retatrutidum novum exemplar therapeuticum pro obesitate repraesentare posse, pendente confirmatione in maioribus, diuturnis probationibus periodi 3.
Tempus publicationis: XXVIII Septembris, MMXXXV